Les essais cliniques en Suisse sont très encadrés

De quoi on parle?
Les faits
Plus de 50 000 Est-Allemands, du temps de la RDA, ont servi de cobayes pour des groupes pharmaceutiques occidentaux, a révélé l’hebdomadaire allemand Der Spiegel. Souvent à leur insu ou sans pouvoir donner leur consentement éclairé. Certaines études ont en effet été menées sur des prématurés ou des alcooliques en crise de delirium tremens.
Le bilan
Des dizaines d’anciens patients envisagent de porter plainte. Mais l’enquête s’annonce compliquée, car les archives de plusieurs hôpitaux de l’ex-RDA ont été détruites.
Le rideau de fer qui coupait l’Allemagne en deux jusqu’en 1989 cachait de dangereuses dérives. Comme ces tests cliniques pratiqués en ex-RDA sur plus de 50 000 personnes, souvent à leur insu, qui ont été révélés par le journal allemand Der Spiegel le 12 mai dernier.
Des pratiques d’un autre temps, qui n’ont plus cours dans les pays industrialisés. En particulier en Suisse, «où des scandales de cette ampleur sont quasiment impossibles», estime Giovan Maria Zanini, pharmacien cantonal et président du Comité d’éthique du Tessin. La recherche sur les êtres humains est en effet désormais très encadrée par la loi.
Les essais cliniques sont indispensables, car «on n’aurait pas de nouveaux traitements sans recherche», souligne Dominique Sprumont, directeur adjoint de l’Institut de droit de la santé de l’Université de Neuchâtel. Ils sont d’ailleurs obligatoires pour obtenir l’autorisation de mise sur le marché d’un nouveau médicament ou dispositif médical. Eux seuls peuvent en effet démontrer l’innocuité, l’efficacité et l’utilité d’un produit à usage thérapeutique.
Recherche d’un avantage réel
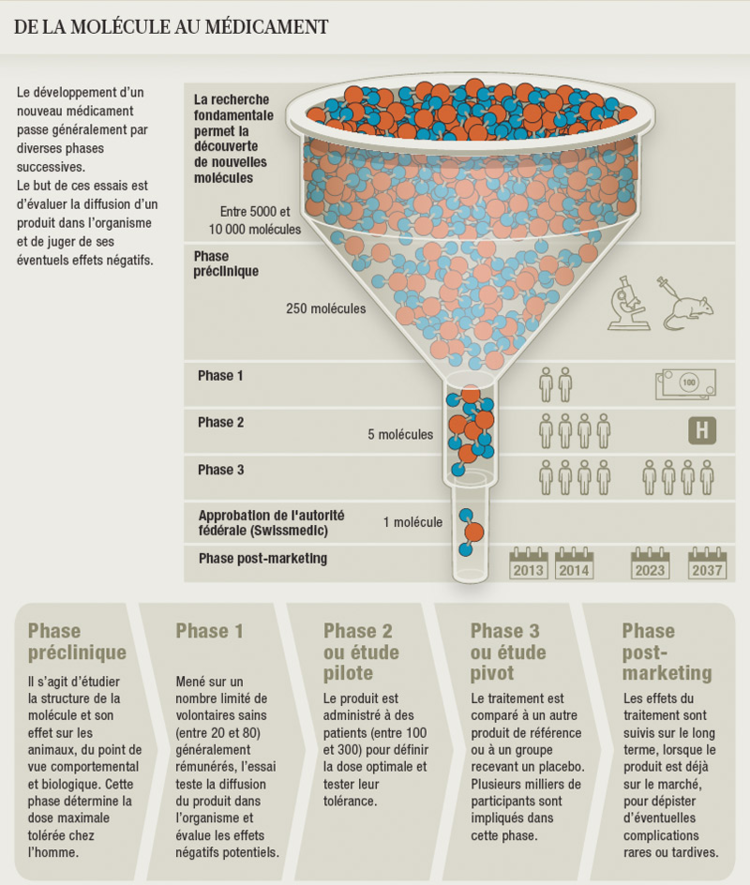
La première phase des tests consiste à vérifier que le médicament est bien toléré par l’être humain. Cette étape implique quelques dizaines de personnes, toutes en bonne santé. «Il y a alors beaucoup d’inconnues sur la substance testée et, en cas de risque, un malade aurait moins de ressources qu’un volontaire sain pour réagir», explique Giovan Maria Zanini.
La phase suivante cherche à démontrer l’efficacité du médicament et est réalisée sur plusieurs centaines de patients «sélectionnés de façon très stricte». Quant à la dernière phase, elle doit prouver que le nouveau produit est utile, c’est-à-dire qu’il apporte un avantage réel sur les médicaments déjà disponibles. Cette notion d’utilité est toutefois relative, reconnaît le pharmacien cantonal, qui constate que les fabricants «cherchent parfois plutôt à démontrer que leur produit est au moins égal aux autres auxquels il pourra faire concurrence».
La bonne pratique exige que l’étude de phase III se fasse avec un «groupe contrôle», composé de patients tirés au sort qui ne reçoivent pas le médicament en cours de test, mais un placebo ou un traitement existant. Elle se fait aussi en «double aveugle»: pour ne pas biaiser les résultats, le cobaye ne sait pas quel produit il a reçu, et l’investigateur l’ignore aussi. Chaque recherche nécessite plusieurs milliers de malades et se déroule dans plusieurs hôpitaux, en Suisse ou dans le monde. Les tests s’achèvent enfin dans les cabinets médicaux afin «d’être aussi proches que possible des situations réelles dans lesquelles le médicament sera prescrit», précise Giovan Maria Zanini.
Ces essais sont très strictement réglementés, notamment par la loi fédérale sur les médicaments et les dispositifs médicaux (LPTh) en vigueur qui sera remplacée en janvier prochain par un nouveau texte adopté en septembre 2011*. Mais, explique Dominique Sprumont, celui-ci «n’apporte aucun changement aux règles de base». Comme l’ancien, il impose en particulier qu’un futur participant à un essai soit bien informé de ce qui l’attend et qu’il donne son consentement éclairé. D’ailleurs, le volontaire «peut à tout moment sortir de l’essai, sans même donner d’explication», rappelle Giovan Maria Zanini.
Très utiles comités d’éthique
La législation impose aussi l’intervention de comités d’éthique cantonaux dont le rôle fondamental est de «protéger les droits des sujets des recherches». Composées de médecins, de pharmaciens, d’experts en éthique, d’infirmiers, mais aussi de juristes et de représentants de la société civile – celui du Tessin inclut par exemple «un journaliste et un théologien» – ces commissions doivent donner leur feu vert pour qu’un essai puisse démarrer. «Notre but n’est pas d’approuver ou de refuser une étude, mais de garantir que la recherche est conçue de façon optimale», explique Giovan Maria Zanini.
Ainsi il arrive au pharmacien cantonal et à ses collègues d’approuver d’emblée des projets «dont le protocole est bien conçu», ou d’en réorienter d’autres «lorsqu’on peut les optimiser». Mais aussi de refuser ceux qui sont «non éthiques ou inutiles». C’est par exemple le cas d’études déjà réalisées par d’autres équipes ou proposées par des entreprises à des fins publicitaires. Les comités d’éthiques suivent ensuite l’étude sur toute sa durée et peuvent à tout moment «réadapter leurs décisions», voire décider d’arrêter les recherches en cas d’événement graves.
Malgré ces garde-fous, il arrive encore que des médecins enrôlent leurs patients dans un essai «en ne les informant pas, ou mal», reconnaît Giovan Maria Zanini. Mais c’est rare et, comme le souligne Dominique Sprumont: «Les Suisses peuvent être rassurés, globalement, ils sont bien protégés.»
Les précautions à prendre
«Participer à un essai clinique, c’est participer à la recherche dont tout le monde bénéficie», souligne d’emblée Dominique Sprumont, directeur adjoint de l’Institut de droit de la santé de l’Université de Neuchâtel. Tout en invitant les futurs participants à avoir ce «réflexe de solidarité», il les incite à être attentifs sur plusieurs points.
Consentement
Celui-là est obligatoire, selon la loi. Mais, précise Dominique Sprumont, il faut se méfier du «malentendu scientifique» qui conduit un patient sollicité par son médecin «à avoir naturellement tendance à conclure que sa participation est dans son intérêt, ce qui n’est pas toujours le cas, et à minimiser les risques qu’il encourt».
Risques et bénéfices
Comme le précise la législation, les bénéfices doivent toujours l’emporter sur les risques. Le patient doit aussi penser aux «inconvénients» qu’entraînera sa participation à l’essai: se rendre fréquemment à l’hôpital, accepter parfois plusieurs prélèvements de sang ou subir des examens parfois désagréables, etc.
Sphère privée
«Le risque informationnel est l’un des plus importants», d’après Dominique Sprumont. Le juriste cite l’exemple de ce Valaisan de 27 ans qui a participé à une étude sur les prédispositions génétiques au cancer de l’intestin. «Lorsqu’il a voulu contracter une nouvelle assurance, la compagnie s’est adressée à son médecin, lequel s’est tourné vers l’investigateur qui a indiqué que ce jeune homme était prédisposé à développer la maladie. Du coup, il a essuyé un refus de couverture.» Une mésaventure qui s’est finalement bien terminée pour le jeune homme.
Dommages
«La recherche est très encadrée et les risques sont minimes», souligne Dominique Sprumont. Mais dans de rares cas il y a des problèmes, qui peuvent avoir des conséquences graves. «Il faut donc vérifier que les investigateurs soient bien couverts par une assurance.»

LA NEUROPROTECTION AU SECOURS DE LA RÉTINE
Face à certaines maladies rétiniennes, la neuroprotection peut aider à ralentir la dégénérescence de cellules essentielles à la vision, comme les photorécepteurs. Cette approche prometteuse est au cœur des travaux du groupe de recherche «Visual and retinal neuroprotection laboratory» de l’Hôpital ophtalmique Jules-Gonin, mené par Naïg Chenais, docteure en neurosciences.

«La thérapie cellulaire traite de plus en plus de maladies»

Vers une détection plus précoce du diabète de type 1
en plus tôt, ouvrant ainsi la voie à une prise en charge plus efficace de la maladie.