Sclérose en plaques
La sclérose en plaques (SEP) est une maladie auto-immune liée à un dérèglement du système immunitaire, qui attaque la gaine de myéline et les fibres nerveuses. Bien que la maladie ait été décrite il y a près de deux siècles, sa cause n’est toujours pas élucidée. Il s’agit d’une maladie complexe et multifactorielle.
Brève description
La sclérose en plaques (SEP) est une maladie inflammatoire et dégénérative, qui entraîne progressivement, mais de manière très variable, des lésions du système nerveux central (SNC). La démyélinisation (destruction de la gaine de myéline qui entoure les axones) est toujours retrouvée dans la SEP, mais la maladie touche non seulement la myéline enroulée autour des axones, mais aussi tous les autres composants du cerveau: axones, cellules gliales et neurones. C’est la maladie neurologique la plus fréquente chez les jeunes adultes. Elle apparaît surtout entre 20 et 30 ans, et atteint plus rarement les enfants et les personnes de plus de 50 ans. Elle touche quelque 10’000 personnes en Suisse et 2,5 millions dans le monde. La forme poussée-rémission a une nette prépondérance féminine (deux malades sur trois sont des femmes).
La SEP est causée par une réaction immunitaire inadaptée qui atteint le SNC (cerveau, moelle épinière ou nerf optique). Ces agressions répétées, aussi dénommées «poussées», produisent des lésions et conduisent progressivement à une dégénérescence du SNC. Les symptômes neurologiques deviennent alors permanents et peuvent entraîner un handicap. Heureusement, même si la maladie reste aujourd’hui fondamentalement incurable, elle est devenue traitable. Il existe maintenant des traitements efficaces pour diminuer la sévérité et la fréquence des poussées, ce qui permet de considérablement retarder la progression vers un handicap permanent et plus sévère. Les perspectives en termes d’évolution et de qualité de vie sont ainsi nettement meilleures qu’il y a quelques années.
Symptômes
La SEP est une maladie hétérogène, dont les premiers symptômes varient d’une personne à l’autre. Dans 30 à 50% des cas, la première poussée se traduit par une combinaison de symptômes. Insidieusement, en quelques jours, un ou plusieurs symptômes signalant une souffrance du système nerveux central (SNC) peuvent se manifester. Comme l’inflammation peut toucher n’importe quelle partie du cerveau, de la moelle épinière ou du nerf optique, les fonctions motrices, sensitives, sensorielles ou cognitives (apprentissage et mémoire) du SNC peuvent toutes être concernées. C’est ainsi que peuvent survenir:
- Des troubles moteurs: ils se manifestent par une faiblesse d’un membre (principalement la jambe, plus rarement le bras ou la main), qui peut être permanente ou aggravée par l’effort (nécessité de faire une pause lors d’une marche parfois très courte). Plus tardivement dans le cours de la maladie, un trouble du tonus musculaire entraînant un sentiment de raideur du membre affaibli (appelé spasticité) peut s’ajouter à la faiblesse. Parfois seule une discrète faiblesse ou une lourdeur du membre est ressentie au début de la marche mais, plus on marche, plus cette lourdeur augmente; on se fatigue alors à un point tel qu’un arrêt s’impose. Il est possible de repartir ensuite, mais la distance parcourue jusqu’à la pause suivante est plus courte. On parle alors de fatigabilité.
-
Des troubles de la sensibilité: il s’agit de sensations subjectives de fourmillements, d’engourdissement, de chaud ou de froid, de serrement (comme être pris dans un étau), voire de brûlures et ou de décharges électriques. Elles sont appelées paresthésies. On parle alors de troubles sensitifs subjectifs, car les sensations décrites ne sont accompagnées d’aucune modification détectable sur le corps.
Il existe d’autres symptômes sensitifs que le médecin peut observer: les troubles sensitifs objectifs. Il s’agit par exemple d’une diminution de la sensibilité au toucher, au piquer ou à la température. Par exemple, en cas de diminution de la sensibilité thermique, on peut tremper un pied dans un bain très chaud sans parvenir à sentir si l’eau est chaude ou froide. Mais lorsqu’on trempe l’autre pied, on ressent la chaleur de l’eau brûlante.
La sensibilité profonde (aussi appelée proprioception) fournit des informations sur la position du corps et des membres dans l’espace. Elle permet de conserver l’équilibre et de se déplacer dans l’obscurité sans tomber, comme une sorte de GPS interne. Si la sensibilité profonde est atteinte, il n’est plus possible de se situer dans l’espace les yeux fermés et se déplacer dans l’obscurité devient alors extrêmement difficile. On se heurte aux meubles, on perd l’équilibre et, comme on corrige la position trop lentement et de manière insuffisante, on risque de chuter. Lorsque ce trouble concerne les mains, il peut par exemple devenir impossible d’utiliser un clavier d’ordinateur sans regarder les touches.
-
Des troubles visuels: ils peuvent être très variés Nous citerons seulement ici l’inflammation du nerf optique (névrite optique). Chez 20% des patients, elle représente la première manifestation de la maladie. La névrite optique est responsable d’une:
- baisse de la vision se manifestant généralement sur un seul œil (très rarement les deux simultanément). La vision de l’œil atteint est diminuée et trouble, comme à travers une vitre sale, avec parfois une zone particulièrement voilée. Les couleurs perçues par l’œil atteint peuvent aussi paraître plus pâles (par exemple, un feu rouge peut sembler rose). Souvent, l’examen ophtalmologique (sauf s’il comprend des examens très spécialisés) ne révélera rien d’autre que la baisse de vision qui empêche de voir correctement ou de lire. Une baisse de la vue d’un seul côté, accompagnée d’une gêne ou d’une douleur de l’œil, surtout si elle augmente lors des mouvements oculaires vers le côté, le haut ou le bas, doit faire suspecter une névrite optique et par conséquent motiver une consultation.
- vision double, ou diplopie, se produisant lorsque l’image se forme à des endroits différents sur la rétine de chacun des deux yeux. Elle est donc perçue à double. Il s’agit ici d’une atteinte des mouvements oculaires (oculomotricité): les deux yeux, dont les mouvements ne sont plus synchronisés comme ils le devraient, ne regardent ainsi plus exactement dans la même direction et on voit deux images. Le fait de fermer ou de masquer un œil rétablit la situation normale et permet de ne plus voir qu’une seule image.
-
Des troubles de l’équilibre et/ou de la coordination: ils sont moins fréquents, du moins au début de la maladie. Les organes de l’équilibre (le système vestibulaire et le cervelet) envoient normalement des informations au cerveau, mais ces informations concernant les mouvements ou la position sont mal analysées. La présence de ce type de troubles indique que le cervelet et/ou le système vestibulaire est touché par la maladie.
On peut avoir l’impression d’être ivre dès le matin, sans avoir bu d’alcool. Bien que notre force soit normale, on se lève difficilement car tout tourne autour de soi. Il s’agit d’un vrai vertige rotatoire: on a l’impression de tourner sur soi-même ou de voir les objets tourner autour de soi. On peut aussi présenter un tremblement quand on désire saisir un objet, le bras et la main ayant alors de la peine à être stabilisés. Il peut être difficile de boire son café sans le renverser. Il se peut aussi qu’en marchant, on dévie d’un côté ou de l’autre, parfois toujours du même côté (encore un coup de notre GPS en détresse).
- Des troubles auditifs: heureusement, l’audition n’est atteinte que dans de rares cas.
- Des troubles urinaires, très gênants et embarrassants. On peut ressentir un besoin urgent d’uriner. Au moment de se soulager, seule une petite quantité d’urine est émise malgré l’intensité du besoin. La vessie ne se vide pas complètement et il faudra très rapidement se rendre à nouveau aux toilettes.
- Chez l’homme, la maladie peut aussi se manifester par des troubles sexuels (de l’érection par exemple).
Au début de la maladie, lors des poussées, les signes et symptômes se répartissent pratiquement à parts égales entre troubles moteurs, sensitifs et visuels. Par la suite, au fur et à mesure des poussées et des années, d’autres symptômes peuvent apparaître, y compris certains qui ne sont pas mentionnés ci-dessus.
Finalement, comme dans presque toutes les maladies inflammatoires, on peut se plaindre d’une fatigue anormale. On ressent un sentiment d’épuisement sans raison, on a des difficultés à faire des choses alors même qu’on en a envie. Il ne s’agit pas d’une dépression, on est simplement épuisé. Cet épuisement s’accentue en cours de journée et une nuit de sommeil, même de bonne qualité, ne l’efface pas complètement. Cette fatigue inexpliquée précède parfois de plusieurs mois la première manifestation neurologique, que l’on appelle poussée inaugurale.
Causes
La cause exacte de la SEP reste inconnue, mais elle est multifactorielle. On ignore ce qui déclenche la première poussée ou les suivantes. Après un temps variable d’une personne à l’autre, la succession de poussées séparées par des temps de répit et de récupération peut être suivie par une lente aggravation des symptômes, sans poussées franches [voir «Evolution et complications possibles»]. Les capacités fonctionnelles s’amenuisent alors au fil des mois, la marche ralentit et des pauses plus fréquentes deviennent nécessaires.
On évoque deux mécanismes principaux responsables de la SEP:
Phénomène inflammatoire
Habituellement, le système immunitaire protège des agents infectieux (virus, bactéries, parasites, champignons) qu’il reconnaît comme étrangers et qu'il détruit par divers mécanismes. Malheureusement, le système immunitaire fait aussi des erreurs et s’attaque parfois à certains constituants normaux de l’organisme qu’il considère (de manière inadéquate) comme étrangers. Dans le cas de la SEP, il s’attaque à la myéline. Entourant les fibres nerveuses, cette substance les protège contre les agressions extérieures et accélère la circulation d’informations. La destruction de la myéline par le système immunitaire est un phénomène d’auto-immunité. Cela forme des plaques de démyélinisation, qui donne le nom à la maladie.
Grâce à l’imagerie par résonance magnétique (IRM), on peut mettre en évidence les lésions inflammatoires. L’inflammation semble varier d’une personne à l’autre, ce qui ne facilite pas la compréhension de ce qui se passe dans la SEP.
Comment démarre cette inflammation? Celle-ci pourrait être due à un virus (vraisemblablement différent pour chaque personne), à une bactérie (moins probable) ou à un facteur lié à l’environnement. Aucun agent infectieux spécifique ne peut actuellement être tenu pour responsable de la SEP, même s’il existe des arguments en faveur d’une infection par un virus (mononucléose infectieuse, hépatite B ou un rétrovirus). On sait par ailleurs que la SEP n’est pas transmissible d’une personne à l’autre, par exemple au conjoint/partenaire d’une personne atteinte.
Des facteurs environnementaux ont aussi été suspectés. Beaucoup de recherches ont été menées sur ces facteurs. Le tabac est aujourd’hui relativement bien établi comme ayant un lien avec le déclenchement et la vitesse de progression de la SEP. Le surpoids et l’obésité ont aussi été mis en cause, ainsi que le manque de vitamine D, et donc d’exposition au soleil. Ce sont les trois facteurs sur lesquels les patients peuvent avoir une influence, tout le reste n’est actuellement qu’expérimental. [voir «Facteurs de risque»].
Phénomène dégénératif
On a longtemps pensé que la dégénérescence nerveuse était initiée par la réaction d’auto-immunité, mais nous savons actuellement que les lésions axonales surviennent très tôt dans la maladie.
La destruction des structures nerveuses ne se traduit pas immédiatement par des signes cliniques, car le cerveau possède une grande réserve fonctionnelle. Tant que les lésions ne dépassent pas un certain nombre et une certaine sévérité destructrice par lésion, le cerveau fait encore bien son travail et on ne décèle rien d’anormal.
La SEP résulte à l’évidence de la combinaison d’une inflammation et d’une neurodégénérescence. On ne sait pas si ces phénomènes se produisent en même temps, à la suite ou indépendamment l’un de l’autre. Bien que ces questions restent très débattues encore aujourd’hui, une réponse immune inadaptée au début, comme facteur déclenchant, avec une inflammation et une dégénérescence précoces, dès la première poussée, semblent être le mécanisme le plus probable. C’est la raison pour laquelle on considère que le traitement doit être mis en route le plus rapidement possible, pour prévenir de nouvelles poussées destructrices et retarder la dégénérescence précoce.
Facteurs de risque
La SEP n’est pas une maladie héréditaire, mais il existe une prédisposition génétique. Pour les vrais jumeaux (jumeaux monozygotes, c’est-à-dire issus du même œuf), si l’un des deux souffre de SEP, le second a un risque de 25 à 30% de développer également une SEP. Mais la génétique n’explique pas tout.
Plusieurs facteurs de risque ont été évoqués:
- Le virus d’Epstein-Barr: notamment responsable de la mononucléose infectieuse, ce virus fait partie de la famille des Herpes. Plus de 99% des patients SEP ont été exposés au virus avant le début de leur maladie. L’exposition au virus Epstein-Barr semble constituer une condition nécessaire, mais non suffisante pour le déclenchement de la SEP.
- Une carence en vitamine D: produite en grande quantité en réaction à l’ensoleillement, la vitamine D aurait un effet protecteur contre la SEP. Cela expliquerait pourquoi vivre dans une région proche des pôles (ensoleillement faible) place les individus dans un groupe à risque. Ceux qui sont nés près de l’équateur (ensoleillement maximal) seraient davantage protégés. Autre élément de preuve: le risque de SEP est inversement proportionnel au temps que les enfants passent dehors. À noter qu’en Suisse, environ 15% des enfants sont carencés en vitamine D.
- Le tabagisme actif ou passif: le tabagisme est un autre facteur de risque pour le développement de la SEP. Les mécanismes sous-jacents restent multiples: contribution à l’inflammation dans les muqueuses, induction d’un état de stress oxydatif et effet toxique sur le système nerveux central. Le tabagisme favorise également la progression de la maladie. L’effet du tabagisme sur l’augmentation du risque de SEP serait réversible après 10 ans de cessation du tabac.
- L’obésité: on observe une augmentation du risque de SEP en cas d’obésité dans l’enfance/adolescence. Les études du microbiome intestinal montrent aussi que les patients souffrant de SEP ont une composition de la flore intestinale différente que les individus ne souffrant pas de SEP. L’alimentation pourrait donc jouer un rôle en influençant le microbiome, mais on ne sait pas encore ce qu’il faudrait changer dans l’alimentation des patients SEP pour avoir un effet sur la maladie.
Traitements
Malheureusement, on ne peut pas encore guérir de la SEP. Toutefois, il existe à ce jour un arsenal thérapeutique varié qui permet dans de nombreux cas de ralentir (voire d’arrêter) de manière efficace et durable la progression de la maladie.
Tous les médicaments utilisés pour traiter la SEP ont une action sur un ou plusieurs des acteurs des mécanismes immunitaires (cytokines, chémokines, lymphocytes T ou B) responsables de l’agression sur le système nerveux central.
Le traitement de base de la SEP se décompose en trois catégories:
1) contrôler la poussée en cours;
2) éviter autant que possible la survenue de nouvelles poussées;
3) éviter la survenue et l’aggravation d’un handicap sur le long terme (durant toute la vie).
A ce traitement de base, vient s’associer un traitement uniquement symptomatique, visant à améliorer les symptômes que la maladie aura générés au cours des années (problèmes urinaires, spasticité, douleurs, etc.).
Traitement des poussées
Les poussées se traitent généralement par un dérivé de la cortisone (méthylprednisolone) en perfusion ou par voie orale. Il s’agit d’un traitement de durée limitée, en principe de trois ou cinq jours. Ce traitement diminue la durée de la poussée et permet d’accélérer la vitesse de récupération de la poussée de SEP. Néanmoins, il n’a pas d’effet sur l’intensité de la récupération (en dehors de certaines poussées très sévères) ni sur la prévention de nouvelles poussées. Leur utilisation n’est pas systématique, notamment si les symptômes sont mineurs (par exemple sensitifs) et/ou d’emblée régressifs.
Traitements de fond
D’autres médicaments, appelés immunomodulateurs ou immunosuppresseurs, sont utilisés pour traiter la SEP. Ils s’adressent en premier lieu aux formes poussées-rémissions et doivent être pris sur le long terme. Ils agissent sur le système immunitaire et visent à atténuer le mécanisme d’auto-immunité et donc à prévenir les poussées. A ce jour, il existe plusieurs médicaments homologués par les autorités de santé (FDA des Etats-Unis, Agence européenne du médicament, Swissmedic). Ils appartiennent à trois catégories:
-
Les traitements injectables:
- les interférons bêta (Avonex, Betaferon, Plegridy, Rebif)
- l’acétate de glatiramère (Copaxone)
-
Les traitements par voie orale:
- le fingolimod (Gilenya)
- le tériflunomide (Aubagio)
- le diméthyl-fumarate (Tecfidera)
- la cladribine (Mavenclad)
-
Les traitements intraveineux :
- le natalizumab (Tysabri)
- l’alemtuzumab (Lemtrada)
- l’ocrélizumab (Ocrevus)
Le traitement de fond est choisi selon le type de SEP, le degré d’activité de la maladie, la tolérance au médicament (limitation des effets secondaires) et les risques de complications.
Ces médicaments ont pour but de diminuer le nombre de poussées cliniques et la survenue de nouvelles plaques sur l’IRM. L’objectif ultime est de limiter au maximum la survenue ou l’aggravation d’un handicap et d’éviter le passage vers la forme chronique progressive.
Jusqu’à récemment, il n’existait pas de réelle option thérapeutique pour la SEP de type primaire progressive. Des études récentes montrent toutefois une certaine efficacité de l’ocrélizumab chez les patients avec une forme primaire progressive. Le ratio risque/bénéfice doit toutefois être sérieusement évalué avant la prise de ce traitement dans les formes progressives.
Traitements symptomatiques
La SEP peut entraîner des gênes fonctionnelles très variables dans leur type et leur intensité. Selon le type de symptômes, différents traitements permettent au patient de faire face à la spasticité, aux douleurs, aux troubles urinaires ou sexuels, et à la fatigue. La prise de médicaments, la physiothérapie, le soutien psychologique ou l’appareillage peuvent être d’une grande aide pour les patients atteints de SEP. La chirurgie n’a en revanche aucune place dans le traitement de la SEP.
Evolution et complications possibles
Sans traitement, la SEP progresse de manière inéluctable. Il n’est pas possible de prédire à l’avance de quelle manière elle va évoluer. Certaines SEP sont très agressives et vont progresser vite, alors que d’autres vont évoluer plus lentement. Mais il est difficile de le savoir dès le début.
Il existe différentes formes de SEP:
- La forme poussée-rémission: il s’agit du type le plus fréquent (85-90% des cas), mais également celui qui répond le mieux aux traitements. La SEP évolue par poussées successives, espacées de périodes de «rémission» stables. La poussée est définie par l’apparition de signes ou symptômes neurologiques d’une durée supérieure à 24 heures, en l’absence de fièvre ou d’infection, dont la récupération peut être partielle ou complète. L’évolution clinique de la maladie est très hétérogène car la fréquence et la sévérité des poussées sont variables d’un patient à l’autre.
- Les critères d’agressivité: les maladies plus «agressives» présentent typiquement un score de handicap plus élevé dès le début de la maladie, un nombre de poussées plus important lors de la dernière année, et une réponse médiocre au traitement de fond. Par ailleurs, une récupération partielle entre les poussées et des intervalles courts entre les attaques sont aussi des facteurs de mauvais pronostic.
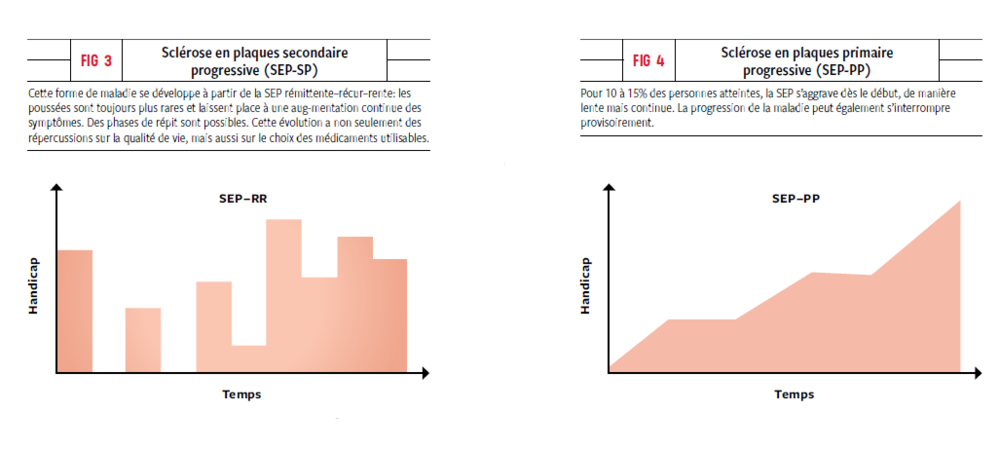
- La forme secondaire progressive: certains patients qui présentent initialement une forme poussée-rémission vont évoluer vers une forme secondaire progressive, caractérisée par une lente aggravation des symptômes. Le passage d’une phase à l’autre est insidieux et les patients sont souvent incapables de préciser la date à laquelle la détérioration lente a débuté. On n’observe plus de poussées franches, mais une dégradation progressive au fil des mois ou des années. Avec les traitements actuels, on estime le risque de passage vers une forme secondaire progressive à 6,4% à 10 ans et à 24,2% à 20 ans.
- La forme primaire progressive: contrairement aux formes poussées-rémissions, les malades atteints d’une SEP primaire progressive (10-15%) présentent dès le début de la maladie une aggravation insidieuse des symptômes, sur une durée de plus d’un an, se portant surtout sur la marche, des troubles urinaires ou des troubles cognitifs. Le risque d’invalidité permanente augmente avec une limitation significative de la mobilité après 5-10 ans. L’atrophie cérébrale et médullaire est souvent détectable dans les stades précoces de la maladie. Cette forme apparaît davantage à un âge plus avancé que la forme poussée-rémission, après 40 ans le plus souvent.
Source : Lalive d’Epinay P. & Du Pasquier R. (2019)
Vivre avec la SEP
Une fois le diagnostic posé, les patients doivent apprendre à vivre avec la SEP et à adapter leur quotidien selon leur état. Un patient atteint de SEP doit être suivi de manière régulière par un neurologue expérimenté et par son médecin traitant. S’il existe une consommation de tabac, il est recommandé de l’arrêter, car le tabagisme accélère la transition de la forme poussée-rémission à la forme secondaire progressive. Quant à l’alimentation, malgré les recommandations qui pullulent sur Internet, il peut être plus délétère qu’autre chose pour un patient SEP de se lancer dans un régime draconien sur la base de recommandations non étayées scientifiquement. Un régime équilibré est toutefois recommandé.
Plus de deux tiers des patients souffrant de SEP sont des femmes. Elles sont souvent jeunes et en âge de procréer. La SEP n’influence ni la fertilité ni le risque de fausse couche ou de malformation du bébé. Sauf exception, la grossesse n’est pas contre-indiquée chez des patientes atteintes de SEP. Le désir d’enfants doit être abordé avec le médecin et le traitement adapté en fonction. La grossesse a un effet protecteur sur la SEP avec une diminution du risque de poussée durant les deuxième et troisième trimestres. Il faut toutefois noter que le risque de poussée augmente durant les trois mois suivant l’accouchement.
Il n’y a également aucune contre-indication au voyage et au travail. Le rythme devra être adapté en fonction du handicap et de la fatigue.
Prévention
Il n’existe actuellement aucun moyen de dépistage. Le diagnostic de SEP ne peut se faire qu’au moment des premières manifestations cliniques (première poussée), même si l’on présume que la maladie était déjà présente (sans provoquer de symptômes) depuis quelques années déjà au moment du diagnostic.
Les traitements ne permettent actuellement pas d’éviter la survenue de la maladie (prévention primaire) mais ils peuvent ralentir son évolution, diminuer le nombre et l’intensité des poussées, diminuer le handicap et ainsi maintenir l’autonomie des personnes plus longtemps (prévention secondaire).
Actuellement, il n’est pas possible d’intervenir directement sur le processus de dégénérescence. Aucune substance n’a encore démontré d’efficacité dans ce domaine. Toutefois, l’instauration précoce d’un traitement pourrait l’éviter de manière indirecte. En diminuant l’agression du système immunitaire sur le système nerveux central (SNC) en réduisant notamment l’inflammation, on lui donne ainsi une chance supplémentaire de se réparer, évitant ou au moins retardant ainsi la dégénérescence. C’est une des raisons qui justifie le traitement précoce de la SEP.
Etant donné la suspicion des facteurs environnementaux que sont le tabac, la carence en vitamine D et l’obésité, il est conseillé de mener une hygiène de vie en conséquence. Une recommandation qui s’étend au-delà du risque de SEP.
Quand contacter le médecin ?
Une première poussée de SEP ne représente que très exceptionnellement une urgence vitale. L’installation parfois brutale des premiers symptômes peut les faire confondre avec ceux d’autres affections nécessitant, elles, un appel immédiat au 144, comme par exemple un accident vasculaire cérébral.
Une consultation médicale rapide se justifie dans tous les cas si des symptômes neurologiques tels que ceux décrits dans le paragraphe consacré aux symptômes se manifestent.
Une fois le diagnostic de SEP posé, un suivi régulier par un neurologue, habituellement une fois tous les six mois, est conseillé. Un suivi médical effectué en parallèle par son médecin de premier recours est également primordial. Cela permettra de surveiller la stabilité du patient et de s’assurer de l’absence d’effets secondaires au traitement.
L’urgence à traiter les poussées est relative. Tout nouveau symptôme ou modification d’un symptôme connu doivent cependant être signalés au médecin. Celui-ci décidera au cas par cas de la nécessité d’une consultation en dehors du suivi habituel. Il pourrait en effet s’agir d’une poussée ou de l’exacerbation d’anciens symptômes par la chaleur ou par une infection.
Informations utiles au médecin
Le médecin (neurologue) s’intéressera à l’apparition des symptômes dans le temps (intervalle entre les différentes manifestations de la maladie) et à leur localisation (parties du corps touchées).
Examens
Depuis 2017, il est possible de poser le diagnostic de SEP chez un patient dès la première poussée, grâce à des nouveaux critères de diagnostic qui prennent en compte, en plus des symptômes cliniques spécifiques, les données radiologiques et biologiques. Poser tôt ce diagnostic est important, car on dispose de thérapies qui sont d’autant plus efficaces qu’elles sont initiées de manière précoce.
Le médecin demandera un examen par IRM pour déterminer la présence de lésions typiques de la SEP. Pour confirmer le diagnostic, il pourra également procéder à un prélèvement du liquide céphalo-rachidien (LCR) par ponction lombaire et à une prise de sang pour exclure d’autres possibles diagnostics. La confirmation du diagnostic impose quelques jours d’attente nécessaires à l’établissement d’un diagnostic sûr, et surtout, indispensable à la mise en place du meilleur traitement possible. Dans de nombreux cas, la phase de diagnostic de certitude peut nécessiter du temps, incluant la répétition d’examens neurologiques et radiologiques.
Références
- Site de la Société suisse de la sclérose en plaques, qui répond aux questions fréquentes et détaille les aspects de la maladie et son traitement. Il fournit aussi des conseils pour la vie quotidienne.
- Site de la Société canadienne de la sclérose en plaques, qui détaille les symptômes et les traitements actuellement disponibles et en préparation.
- Site de l’Institut national de la santé et de la recherche médicale (Inserm), des informations plus pointues pour ceux qui le souhaitent.
- Site de la Société francophone de la SEP, qui dispense conseils, informations pratiques et recommandations thérapeutiques, tout en développant un réseau à l’internationale.
- Fondation pour l’aide à la recherche sur la SEP (France), qui s’engage pour une meilleure compréhension de la maladie, notamment à travers le soutien à la recherche.
- «La sclérose en plaques douloureuse». Chofflon M, Lalive Ph. Rev Med Suisse 2008;4:1491-97.
- «Traitement de la sclérose en plaques: nouveautés et complications». Schluep M, Lalive PH, Du Pasquier RA. Rev Med Suisse 2013;9:940-3.
- L’essentiel: Sclérose en plaques. Lalive d’Epinay P., Du Pasquier R. RMS Editions, 2019.
Qu'est-ce que c'est ?
Des médecins ont rédigé pour vous des réponses aux questions que vous vous posez à propos des maladies les plus fréquentes.
Attention: ces informations ne remplacent pas une consultation chez le médecin.
Numéros d'urgence
Ambulance |
144 |
||
|
Centre anti-poison |
145 |
|
|
|||
Service de secours-Ambulance |
112 |
||
Service de secours-Ambulance |
15 |
||
Service de secours-Ambulance |
911 |